Santiago de Compostela
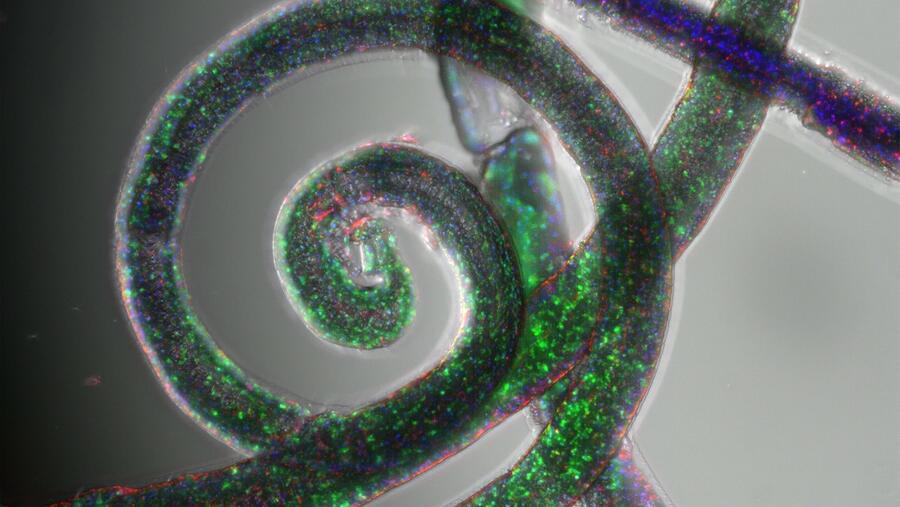
Os investigadores da USC, Juan Manuel Ruso Veiras e Ramón Rial, lograron desenvolver unha plataforma microfluídica multifásica que permite fabricar modelos tridimensionais de cancro dentro de fibras de hidroxel “cun nivel de control e reprodución ata agora inédito”. Este sistema reproduce con gran fidelidade as condicións dun tumor real, é dicir, as presións internas, a dispoñibilidade de nutrientes, o contacto entre as células malignas e as células da contorna, nunha única fibra estable, ademais de facilitar enormemente a manipulación experimental. O estudo realizado en colaboración coa Universidade do Minho e titulado ‘Precise multiphase hydrogel engineering of miniaturized 3D cancer architectures via computationally informed microfluidics’ acaba de publicarse na revista Matter.
Os investigadores valéronse da capacidade da microfluídica para manipular simultaneamente tres fases: líquida, xel e gas; de xeito que, inxectando diferentes combinacións, “conseguimos xerar fibras continuas con burbullas de aire incorporadas na súa matriz interna ou cun núcleo continuo líquido segundo as necesidades de cada modelo”. Con anterioridade aos ensaios experimentais, realizaron simulacións computacionais de dinámica de fluídos que lles permitiron predicir a morfoloxía final das fibras, o tamaño e a distribución das burbullas, ou o grosor do núcleo líquido, en función dos caudais e das propiedades dos materiais empregados. Deste xeito, reduciron drasticamente o número de iteracións in vitro e aceleraron o proceso de optimización, podendo anticipar os resultados de antemán “sen necesidade de gastar unha pinga de reactivo ou poñer un pé no laboratorio húmido”, explican dende o equipo investigador tamén integrado por Carlos F. Guimaraes, Luca Gasperini, Alexandra Brito, Rui R. Costa e Rui L. Reis.
Estrés sólido
Para formular os hidroxeis, empregáronse polímeros naturais biocompatibles: alxinato de sodio e ácido hialurónico no núcleo, proporcionando un medio nutritivo adecuado para as células, e goma gellan na envolvente sólida das fibras, modulando as composicións para controlar a rixidez e o estrés mecánico das estruturas. Deste xeito, puideron recrear distintas condicións de rixidez ou estrés sólido semellantes ás que se observan en tecidos tumorais. “Así, no modelo de esferoides, as burbullas de aire atrapadas dentro do hidroxel xeran bolsas líquidas onde as células de glioblastoma se agregan e proliferan formando esferoides de tamaño regulable”, explican. Estas esferas medran baixo condicións de estrés sólido comparables ás experimentadas por células tumorais in vivo, “o que nos permite estudar como a mecanotransdución inflúe a resistencia a quimioterapias como a doxorrubicina”.
Por outra banda, no modelo de fiberoides, o fluxo de ácido hialurónico forma un núcleo continuo seguido pola xelificación de goma gellan arredor del, “de xeito que obtemos fibras de diámetro uniforme nas que as células canceríxenas (glioblastoma) se aloxan no núcleo e as sans (astrócitos) na capa externa”. Deste modo, lograron reproducir a interacción directa entre tumor e estroma nunha contorna espacialmente estruturada, eliminando manipulacións adicionais e favorecendo comunicacións paracrinas e contacto directo entre ambas as poboacións celulares.
Outras técnicas
Noutras técnicas 3D, adoita ser necesario manexar cada esferoide ou cada agregado celular por separado o que implica “un proceso lento e laborioso, co noso método basta con incubar as fibras que conteñen eses modelos e levalas aos ensaios de viabilidade ou aos cribados de fármacos”. Iso tradúcese en aforro de tempo, de reactivos e, en definitiva, en poder avaliar a eficacia dos tratamentos sobre centos de estruturas idénticas sen esforzos adicionais.
Os resultados amosan que, no modelo de esferoides, ao reproducir condicións de estrés sólido dentro das fibras, as estruturas responden de forma dose-dependente á doxorrubicina, confirmando o valor desta plataforma para avaliar fármacos en condicións mecánicas realistas. Do mesmo xeito, o modelo de fiberoides permitiu recrear nunha arquitectura 3D continua as interaccións entre células de glioblastoma e astrócitos, observando procesos como invasión tumoral, remodelado da matriz extracelular e transferencia mitocondrial nunha contorna fisiolóxicamente relevante. “A posibilidade de configurar estruturas tan diversas e controladas ofrece un nivel de versatilidade, detalle e precisión que non se consegue con sistemas bidimensionais ou con esferoides convencionais”, sinalan.
En conxunto, esta aproximación multifásica microfluídica supón un avance substancial na creación de modelos in vitro de cancro. A reproducibilidade de tamaño, forma e contorno mecánico das estruturas, así como a facilidade para manipular unha soa fibra en lugar de centos de agregados illados, abren novas posibilidades para o cribado de fármacos, os estudos de mecanobioloxía e mesmo as estratexias de medicina de precisión baseadas en liñas celulares derivadas de pacientes. Con estas capacidades, a plataforma ofrece unha ferramenta “potente” para avanzar na investigación do cancro e acelerar o desenvolvemento de terapias máis efectivas e personalizadas.